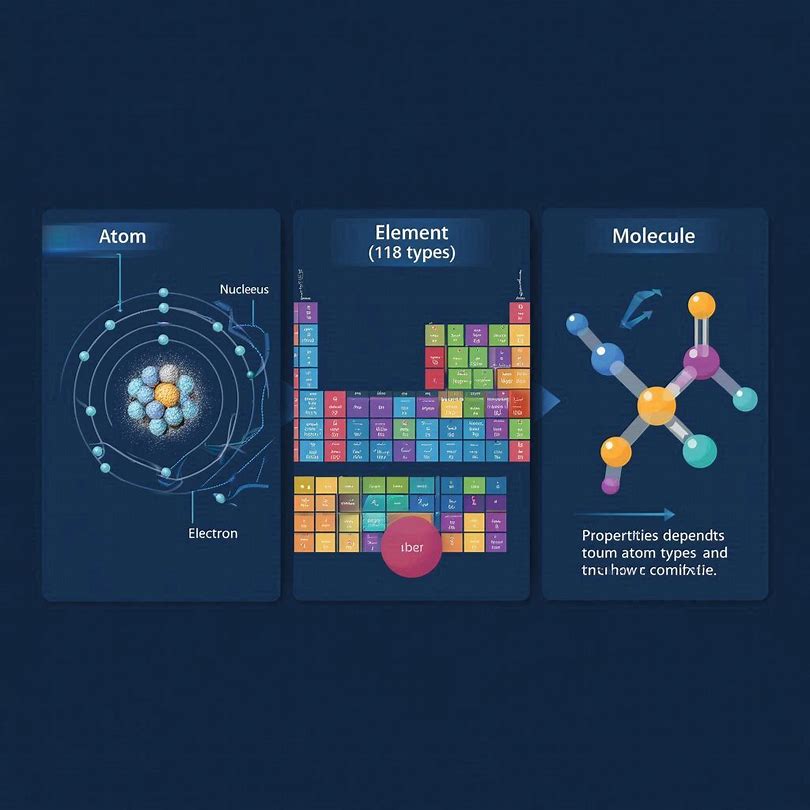
水、空気、金属、プラスチック。私たちの身の回りは、すべて「物質」でできています。物質をどこまでも細かく分けていくと、最終的に「原子」という粒に行き着きます。原子は、さらに中心の原子核と、その周囲を取り巻く電子からなる構造を持つことがわかっていますが、いったん原子という粒を最小単位ととらえたのが化学の出発点です。
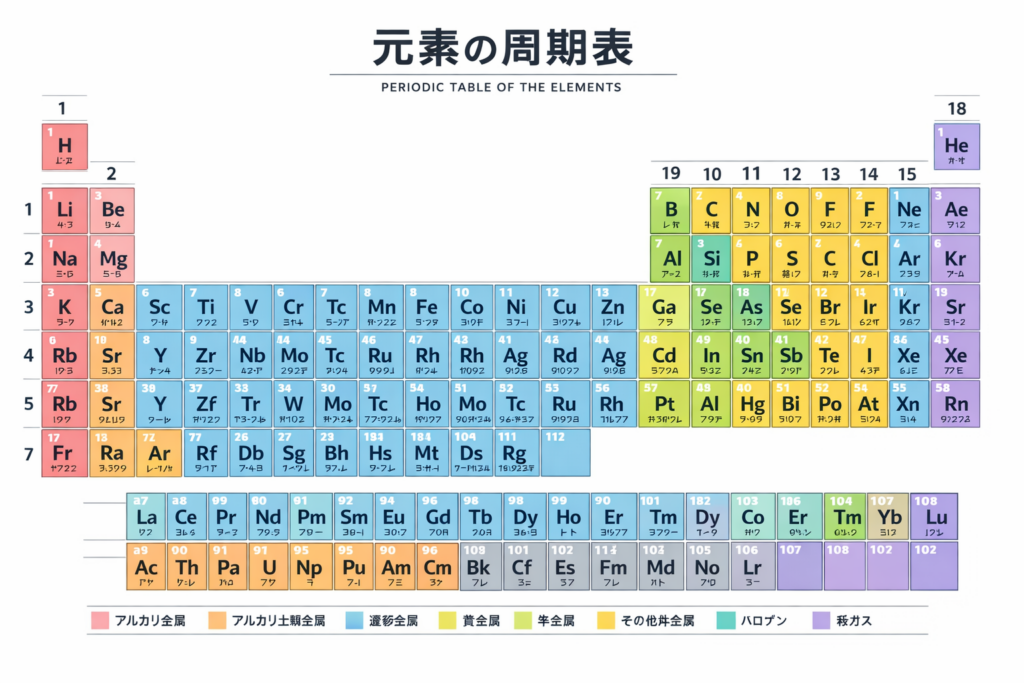
この原子の種類ですが、水素、酸素、鉄など、現在118種類が確認されています。元素とは、原子の「種類」のことです。
118種類がまったく別々の性質を持つわけではなく、似たようなものが分類されています。それを周期表といいます。周期表は縦(族)に並ぶ元素は、化学的性質が似ています。
物質はどう変わるか ― 化学式と化学反応
分子とは、複数の原子が結びつき、その物質としての性質します。
重要なのは、性質は原子の種類だけでなく、組み合わさり方で決まるという点です。たとえば、炭素と水素だけで構成されていても、組み合わせによってメタン(CH₄)、エタノール(C₂H₆O)、ポリエチレンと、まったく異なる物質になります。
化学式とは、物質の「設計図」です。どの元素が、いくつ、どう組み合わさっているかを示します。化学反応式は、原子の組み替えの記録であり、反応の前後で原子の種類と数は変わりません。これが質量保存の法則です。
たとえば燃焼反応:
CH₄ + 2O₂ → CO₂ + 2H₂O
この式が示しているのは、メタン1分子が酸素2分子と反応して二酸化炭素1分子と水2分子になる、ということだけではありません。「原料として何をどれだけ用意すべきか」「廃棄物として何がどれだけ出るか」という、実務上の見積もりの根拠でもあります。
原子や分子は小さすぎるため、一粒ずつカウントするのは不可能です。私たちは「個数」ではなくモルという単位で扱います。1 molは約6.02×10²³個の粒子を意味します。
状態とエネルギー ― 固体・液体・気体
物質の状態は、分子の並び方と動き方で決まります。
- 固体:規則正しく並び、その場で振動する
- 液体:互いに近いが、位置は流動的
- 気体:自由に飛び回る
状態が変わっても、分子そのものは変わりません。変わるのは、エネルギーと配置です。氷も水も水蒸気も、すべてH₂O分子です。
産業では、温度と圧力を制御することで物質の状態を使い分けます。
超臨界流体は、液体と気体の性質を併せ持つ状態で、コーヒーからカフェインを抽出したり、半導体の洗浄に使われたりします。
物質の性質を決める ― 化学結合
原子同士が結びつく仕組みには、大きく3種類があります。
- イオン結合:硬いが脆い、溶液で電気を通す(食塩など)
- 共有結合:分子の形が性質を左右する(水、ダイヤモンド、プラスチック)
- 金属結合:自由電子が電気・熱・加工性を生む(鉄、銅、アルミニウム)
材料の強度、融点、導電性は、すべてこの違いから説明できます。たとえば、
- なぜ金属は電気を通すが、プラスチックは通さないのか? → 自由電子の有無
- なぜセラミックスは硬いが衝撃に弱いのか? → イオン結合の方向性
- なぜダイヤモンドは最も硬いのか? → 共有結合の三次元ネットワーク
これらの理解があると、材料選定が「経験則」ではなく「根拠」に基づいて行えるようになります。
密度・濃度・純度
密度は物質ごとにほぼ一定であり、正体不明の物体を見分ける重要な手がかりになります。軽量化設計や材料比較では、比強度・比剛性といった指標が使われます。
たとえば:
- 航空機材料にアルミ合金が使われる理由 → 鉄より軽く、十分な強度がある
- 炭素繊維強化プラスチック(CFRP)の優位性 → 密度が低く比強度が高い
濃度
ppmや%といった単位は、環境・医療・品質管理で不可欠です。
「危険かどうか」は、物質名だけでなく濃度で決まります。
- 塩素は10 ppmで殺菌効果、1000 ppmで有毒
- アルコールは70%で消毒効果最大、100%では揮発が速すぎて効果が落ちる
濃度の理解は、排水処理、医薬品の調製、食品添加物の管理など、多くの場面で必須です。
酸と塩基は、水溶液中での粒子のふるまいとして定義されます。酸は水素イオン(H⁺)を放出し、塩基は水酸化物イオン(OH⁻)を放出する、あるいは水素イオンを受け取ります。
pHは対数尺度であり、1の違いは10倍の差を意味します。pH 3の液体はpH 4の液体より10倍酸性が強く、pH 2ならさらに10倍、つまり100倍強い酸性です。
- 排水管理(法規制値を守るための中和処理)
- 腐食防止(金属が溶けやすいpH領域の把握)
といった判断が「感覚」ではなく「根拠」に基づいて行えるようになります。
まとめ
世界は連続して見えますが、実際にはすべてが「粒のルール」に従って動いています。
そのルールを理解することは、社会の中で科学技術を判断する力です。


コメント